Фосфорно-азотные удобрения
14-04-2016, 22:46
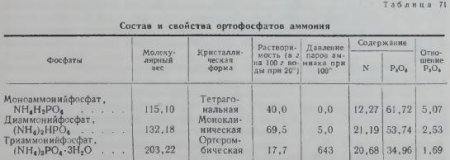
Аммофос и диаммофос. Ортофосфорная кислота — H3PO4 образует с аммиаком три вида солей: моно-, ди- и триаммонийфосфаты: NH4H2PO4, (NH4)2HPO4 и (NH4)3PO4. Триаммонийфосфат при обыкновенной температуре легко распадается, выделяя газообразный аммиак, и, как неустойчивое соединение, не применяется на удобрение. Диссоциация диаммонийфосфата при обыкновенной температуре идет весьма медленно и не имеет практического значения. Моноаммонийфосфат, употребляемый на удобрения, получил название аммофоса, диаммонийфосфат — диаммофоса.
Диаммофос производится путем насыщения аммиаком чистой фосфорной кислоты, полученной методом электровозгонки. Химический состав его близок к составу чистой соли диаммонийфосфата.
Аммофос производится путем усреднения аммиаком фосфорнокислой вытяжки из фосфоритов.
Кроме того, в составе аммофоса имеются фосфаты железа и алюминия, гипс и кремнекислота. Аммофос выпускается иногда с добавкой сульфата аммония для доведения в нем содержания азота и фосфора до 20%.
В России промышленное производство аммофоса и диаммофоса вполне возможно и целесообразно; технология его получения разнообразна.
Состав наших аммофосов будет зависеть от исходного сырья. Аммофосы из апатита содержат около 50% воднорастворимой P2O5 и по своему качеству лучше заграничных. Аммофосы из низкопроцентных фосфоритов содержат значительное количество воднонерастворимой P2O5 (5—15%) и нерастворимого в воде N (0,5—1,5%) в основном виде комплексных аммиачных солей железо-и алюмофосфорных кислот NH4H2(FePO4)2 и NH4H2(AlPO4)2. Усвояемость фосфорной кислоты этих солей меньше, чем воднорастворимой P2O5 аммофоса или суперфосфата. По данным опытов, усвояемость ее равна 40% усвояемости воднорастворимой P2O5. Поэтому при установлении количества усвояемой P2O5 в аммофосе, получаемой из низкопроцентных фосфоритов, следует к воднорастворимой P2O5 добавлять 40% содержания нерастворимой в воде P2O5.
Аммофос из фосфоритов Каратау содержит значительные количества нерастворимых в воде фосфатов, в частности фосфатов магния. При его анализе следует определять как воднорастворимую P2O5, так и растворимую в лимонной кислоте.
Аммофос и диаммофос являются биологически кислыми удобрениями, так как аммиак при нитрификации превращается в азотную кислоту. Применение этих удобрений вызывает подкисление почвы. Ho это их свойство не следует преувеличивать, так как фосфаты аммония вносятся по расчету содержания в них фосфорной кислоты, а не азота, отношение же N : P2O5 в аммофосе 1 : 5 — 1 : 4, а в диаммофосе 1 : 2,5. Это соотношение неуравновешенное, и в большинстве случаев они будут вноситься совместно с другими азотными удобрениями. Поэтому фосфаты аммония вводят в состав других сложных удобрений (нитрофосок, аммофосок и др.).
Фосфаты аммония, как воднорастворимые удобрения, рекомендуются для поверхностного внесения (подкормка растений). Диаммофос может повреждать корни молодых растений при местном внесении, поэтому его следует вносить в рядки так, чтобы между семенами и удобрениями не было непосредственного соприкосновения.
Применение аммофоса должно получить у нас большое значение на почвах черноземного типа и в орошаемых районах на почвах каштановых и сероземах, особенно под технические культуры, а также для подкормки овощных и плодовых растений.
Аммонизированные суперфосфаты получаются насыщением суперфосфата безводным аммиаком, аммиачным раствором или аммиакатами, т. е. растворами солей NH4NO3, Ca(NO3)2 и CO(NH2)2 в безводном аммиакате. Процесс обработки суперфосфата аммиаком был предложен еще в 1872 г. Мак Дуголом, но первая промышленная продукция была выпущена во Франции в 1924 г («супером»), а с 1928 г. аммонизация суперфосфата стала широко применяться в США.
При аммонизации суперфосфата в зависимости от количества введенного аммиака происходят различные реакции.
Первой, самой слабой степенью аммонизации суперфосфата является нейтрализация свободной кислотности суперфосфата с образованием фосфата аммония H3PO4+NH3=NH4РO4. В этом случае аммонизированный суперфосфат может применяться в гранулированном виде. Если аммиак вводится из расчета внесения 1 моль NH3 на 1 моль Ca(H2PO4)2 (сверх количества, необходимого для нейтрализации свободной фосфорной кислоты суперфосфата), то происходит образование не только моноаммонийфосфата, но и дикальцийфосфата.
При такой степени аммонизации усвояемость фосфора при внесении в порошковидном состоянии не меньше, чем в исходном продукте. Дальнейшая аммонизация приводит к образованию трех кальциевого фосфата:
Усвояемость фосфора такого суперфосфата падает. Если обработку суперфосфата вести аммиакатами, то можно получить продукт с хорошей усвояемостью P2O5 при соотношении N : P2O5 до 1 : 2.
Аммонизация суперфосфата улучшает его физические свойства. Аммонизированные суперфосфаты являются весьма ценным компонентом для изготовления смешанных удобрений, особенно при участии NH4NO3. Так как азотнокислый аммоний является в России основным азотным удобрением, аммонизация суперфосфатов — желательная операция для подготовки суперфосфата к смешению с азотнокислым аммонием.
Возможна аммонизация двойных суперфосфатов, в этом случае;реакция не идет далее образования дикальцийфосфата, так как в двойном суперфосфате нет гипса. Практического значения аммонизация двойного суперфосфата не получила.
Диаммофос производится путем насыщения аммиаком чистой фосфорной кислоты, полученной методом электровозгонки. Химический состав его близок к составу чистой соли диаммонийфосфата.
Аммофос производится путем усреднения аммиаком фосфорнокислой вытяжки из фосфоритов.
Кроме того, в составе аммофоса имеются фосфаты железа и алюминия, гипс и кремнекислота. Аммофос выпускается иногда с добавкой сульфата аммония для доведения в нем содержания азота и фосфора до 20%.
В России промышленное производство аммофоса и диаммофоса вполне возможно и целесообразно; технология его получения разнообразна.
Состав наших аммофосов будет зависеть от исходного сырья. Аммофосы из апатита содержат около 50% воднорастворимой P2O5 и по своему качеству лучше заграничных. Аммофосы из низкопроцентных фосфоритов содержат значительное количество воднонерастворимой P2O5 (5—15%) и нерастворимого в воде N (0,5—1,5%) в основном виде комплексных аммиачных солей железо-и алюмофосфорных кислот NH4H2(FePO4)2 и NH4H2(AlPO4)2. Усвояемость фосфорной кислоты этих солей меньше, чем воднорастворимой P2O5 аммофоса или суперфосфата. По данным опытов, усвояемость ее равна 40% усвояемости воднорастворимой P2O5. Поэтому при установлении количества усвояемой P2O5 в аммофосе, получаемой из низкопроцентных фосфоритов, следует к воднорастворимой P2O5 добавлять 40% содержания нерастворимой в воде P2O5.
Аммофос из фосфоритов Каратау содержит значительные количества нерастворимых в воде фосфатов, в частности фосфатов магния. При его анализе следует определять как воднорастворимую P2O5, так и растворимую в лимонной кислоте.
Аммофос и диаммофос являются биологически кислыми удобрениями, так как аммиак при нитрификации превращается в азотную кислоту. Применение этих удобрений вызывает подкисление почвы. Ho это их свойство не следует преувеличивать, так как фосфаты аммония вносятся по расчету содержания в них фосфорной кислоты, а не азота, отношение же N : P2O5 в аммофосе 1 : 5 — 1 : 4, а в диаммофосе 1 : 2,5. Это соотношение неуравновешенное, и в большинстве случаев они будут вноситься совместно с другими азотными удобрениями. Поэтому фосфаты аммония вводят в состав других сложных удобрений (нитрофосок, аммофосок и др.).
Фосфаты аммония, как воднорастворимые удобрения, рекомендуются для поверхностного внесения (подкормка растений). Диаммофос может повреждать корни молодых растений при местном внесении, поэтому его следует вносить в рядки так, чтобы между семенами и удобрениями не было непосредственного соприкосновения.
Применение аммофоса должно получить у нас большое значение на почвах черноземного типа и в орошаемых районах на почвах каштановых и сероземах, особенно под технические культуры, а также для подкормки овощных и плодовых растений.
Аммонизированные суперфосфаты получаются насыщением суперфосфата безводным аммиаком, аммиачным раствором или аммиакатами, т. е. растворами солей NH4NO3, Ca(NO3)2 и CO(NH2)2 в безводном аммиакате. Процесс обработки суперфосфата аммиаком был предложен еще в 1872 г. Мак Дуголом, но первая промышленная продукция была выпущена во Франции в 1924 г («супером»), а с 1928 г. аммонизация суперфосфата стала широко применяться в США.
При аммонизации суперфосфата в зависимости от количества введенного аммиака происходят различные реакции.
Первой, самой слабой степенью аммонизации суперфосфата является нейтрализация свободной кислотности суперфосфата с образованием фосфата аммония H3PO4+NH3=NH4РO4. В этом случае аммонизированный суперфосфат может применяться в гранулированном виде. Если аммиак вводится из расчета внесения 1 моль NH3 на 1 моль Ca(H2PO4)2 (сверх количества, необходимого для нейтрализации свободной фосфорной кислоты суперфосфата), то происходит образование не только моноаммонийфосфата, но и дикальцийфосфата.
Ca (H2PO4)2 + NH3 = NH4H2PO4 + CaHPO4.
При такой степени аммонизации усвояемость фосфора при внесении в порошковидном состоянии не меньше, чем в исходном продукте. Дальнейшая аммонизация приводит к образованию трех кальциевого фосфата:
Ca(H2PO4)2 + 2CaSO4 * 2Н2O + 4NH3 = Ca3(PO4)2 + 2(NH4)2SO4 + 2Н2O.
Усвояемость фосфора такого суперфосфата падает. Если обработку суперфосфата вести аммиакатами, то можно получить продукт с хорошей усвояемостью P2O5 при соотношении N : P2O5 до 1 : 2.
Аммонизация суперфосфата улучшает его физические свойства. Аммонизированные суперфосфаты являются весьма ценным компонентом для изготовления смешанных удобрений, особенно при участии NH4NO3. Так как азотнокислый аммоний является в России основным азотным удобрением, аммонизация суперфосфатов — желательная операция для подготовки суперфосфата к смешению с азотнокислым аммонием.
Возможна аммонизация двойных суперфосфатов, в этом случае;реакция не идет далее образования дикальцийфосфата, так как в двойном суперфосфате нет гипса. Практического значения аммонизация двойного суперфосфата не получила.